本文要點:結直腸癌(CRC)是全球發病率最高的五大癌癥之一。針對局部晚期CRC,臨床推薦采用術前同步放化療方案。作為傳統癌癥治療手段,放療(RT)不僅能控制局部腫瘤生長,還能誘導免疫原性細胞死亡并引發系統性免疫應答。鑒于CRC對放療敏感性較差,提升放射增敏效果成為亟待解決的關鍵問題。雖然術中影像技術取得進展,但實現結直腸腫瘤實時精準切除并確保切緣陰性仍是重大臨床挑戰。本研究開發的新型多功能熒光納米探針RVLu@ICG具有近紅外二區(NIR-II)發光特性:通過環狀精氨酸-甘氨酸-天冬氨酸五肽(c(RGDfK))修飾實現腫瘤靶向富集,并在電離輻射下顯著增強活性氧(ROS)生成。這種協同機制既能增強放射增敏效果,又可促進放療誘導的腫瘤免疫微環境重塑。NIR-II熒光成像導航系統成功在微小腫瘤模型、肌層浸潤模型和腹膜轉移模型中實現精準手術引導。該納米探針在體外和體內實驗中均表現出優異的生物相容性,為CRC治療建立了可靠的精準診療一體化平臺。


圖1. 合成和應用的示意圖:RVLu@ICG用于NIR-II熒光引導靶向放射增敏、免疫微環境調節和精確CRC手術切除的納米探針

圖2. 納米探針的合成與表征
采用傳統雙相合成法和硬模板法制備了病毒模擬介孔二氧化硅納米顆粒(VSi)。在弱堿性環境中溫和攪拌72小時后,透射電子顯微鏡(TEM)觀察到成功制備出粒徑約100納米、具有典型病毒樣表面結構的均勻顆粒(圖2A)。以VSi為核模板,六水合硝酸镥(Lu(NO3)3·6H2O)為镥源,烏洛托品為還原劑,經80/90℃反應17小時后,成功獲得直徑約110納米的均一中空病毒樣介孔氧化镥納米球(VLu),其表面呈現粗糙形貌(圖2A)。掃描電子顯微鏡(SEM)進一步證實VSi與VLu均具有均勻的仿生病毒樣納米結構(圖2B)。高角度環形暗場掃描電鏡(HAADF)結合元素分布圖顯示,Lu和氧(O)在單個VLu納米結構中呈均勻空間分布,驗證了镥整合中空納米探針的成功構建(圖2C)。通過氨基硅烷(APTES)對VLu進行氨基功能化后,使用NHS/EDC將c(RGDfK)肽段共價偶聯至VLu表面(RVLu)。高分辨透射電鏡(HRTEM)分析表明RVLu由相互貫穿的納米顆粒組成(圖2D),無晶格條紋的特征證實其非晶態性質。紫外-可見吸收光譜在258nm處出現c(RGDfK)肽段特征吸收峰(圖2E),結合標準校準曲線定量顯示c(RGDfK)負載率為17.01%(質量比1:11.76)。Zeta電位測試顯示各制備階段表面電荷變化(圖2F),動態光散射(DLS)檢測顯示VLu、VLu-NH2和RVLu的流體力學直徑分別為112.45nm、120.54nm和136.87nm(圖S6),共同佐證了肽段偶聯策略的有效性。
隨后將ICG封裝于中空RVLu顆粒中(RVLu@ICG),根據ICG標準曲線計算其負載效率達23.56%(圖2G)。吸收光譜顯示RVLu@ICG與游離ICG均在780nm附近存在特征峰,證實ICG成功嵌入納米探針空腔(圖2H)。在808nm激光激發并通過1000nm長通濾光片檢測時,兩者均表現出超過1000nm的NIR-II特征發射譜(圖2I),驗證了其在NIR-II窗口的光學活性。通過紫外分光光度計和電感耦合等離子體測定,RVLu@ICG中ICG、Lu與c(RGDfK)的摩爾比為1:330.65:18.54。

圖3. 體外RVLu@ICG細胞毒性、細胞攝取和RT敏感性測試
癌細胞精準識別是實現腫瘤組織精準治療的關鍵。采用流式細胞術和共聚焦激光掃描顯微鏡(CLSM)評估RVLu@ICG的腫瘤靶向性能。在檢測細胞攝取前,通過溶血實驗和細胞增殖實驗驗證納米探針的生物相容性。溶血實驗結果顯示(圖3A),RVLu@ICG在所有濃度(0-80μM)下的溶血率均低于5%,表明其具有良好的血液相容性。實驗評估發現,經c(RGDfK)修飾的RVLu@ICG在流式檢測中細胞攝取量約為未修飾VLu@ICG的兩倍(圖3B),差異具有統計學意義(P<0.001)。CLSM觀察顯示,與CT26細胞共孵育4小時后,RVLu@ICG組的紅色熒光(ICG)強度是VLu@ICG組的三倍(圖3C;P<0.01)。通過競爭抑制實驗發現,預先用過量c(RGDfK)肽處理的細胞對RVLu@ICG攝取顯著降低(流式結果圖S17-18,P<0.001;CLSM結果圖3C,P<0.0001),證實c(RGDfK)功能化能賦予镥基納米探針精準識別腫瘤細胞的能力。
隨后研究者進一步評估了RVLu@ICG在放射治療(RT)中的增敏效應。X射線照射(4 Gy)條件下,納米顆粒(Lu3?濃度=20 μM)的細胞毒性顯著高于單純放療組(P < 0.001),表明納米顆粒介導的RT能顯著增強輻射誘導的腫瘤細胞死亡(圖3D)。通過克隆形成實驗發現,相較于單純RT組,RVLu@ICG聯合處理組形成的存活細胞克隆數顯著減少(P < 0.001)(圖3E)。流式細胞術檢測顯示RVLu@ICG+RT組的細胞凋亡率顯著高于單純RT組(P < 0.001)(圖3F)。值得注意的是,镥基納米顆粒(RVLu@ICG)的放射增敏效果明顯優于釓基(RVGd@ICG)和釹基(RVNd@ICG)材料(P < 0.001)。基于電離輻射通過活性氧(ROS)介導DNA損傷的機制,DCFH-DA染色顯示:照射后RVLu@ICG組的綠色熒光強度與MFI值均顯著高于PBS對照組(P < 0.0001)(圖3H,I),而未照射組的熒光信號均較弱。流式檢測證實RVLu@ICG+RT處理的CT26細胞ROS水平是單純RT組的8倍(圖3G),表明該納米探針能通過顯著提升X射線誘導的ROS產量,進而導致結直腸癌細胞凋亡/壞死。這些結果共同驗證了RVLu@ICG具有強大的放射增敏作用,能有效抑制癌細胞增殖并誘導其死亡,是一種前景放射治療納米劑。

圖4. RVLu@ICG在體內安全性和腫瘤靶向效率評估
在開展活體熒光成像研究前,本文首先評估了RVLu@ICG的體內安全性。將健康雌性BALB/c小鼠隨機分為四組實驗,結果顯示RVLu@ICG組與PBS對照組相似,在四周觀察期內均未出現體重異常波動(圖4A)。通過系列采集靜脈血樣(第0/1/7/28天)進行肝腎功能檢測及血常規分析,發現肌酐(CREA)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)和尿素氮(BUN)水平保持穩定(圖4B),血小板(PLT)、紅細胞(RBC)、淋巴細胞(Lymph)及白細胞(WBC)計數亦無顯著變化(圖4C)。蘇木精-伊紅(HE)染色器官切片顯示兩組均未出現明顯病理損傷(圖4D),證實RVLu@ICG具有良好生物安全性。基于體外腫瘤靶向性和體內低毒性的驗證結果,研究者在BALB/c小鼠皮下接種CT26-Luc腫瘤細胞建立模型。通過尾靜脈注射ICG、VLu@ICG或RVLu@ICG后,采用808 nm激發光(100 mW/cm2)和1000 nm長通濾光片進行NIR-II熒光成像。結果顯示ICG組腫瘤區域熒光信號微弱,而RVLu@ICG組在注射48小時后呈現強烈的腫瘤特異性熒光(圖4E,F),其最大腫瘤背景比(TBR=6.50±1.10)顯著高于VLu@ICG組(4.49±0.63)和ICG組(2.49±1.08)(圖4G,P<0.05)。熒光信號在96小時后消退,但RVLu@ICG組在所有時間點均保持更高腫瘤熒光強度(圖4F)。根據Rose標準(TBR>5可滿足精準成像),RVLu@ICG展現出更優的腫瘤鑒別能力。通過預注射c(RGDfK)的阻斷實驗進一步驗證靶向特異性,48小時后RVLu@ICG組的熒光強度(7.65±1.61)顯著高于阻斷對照組(2.40±0.44)(圖4H;圖S26,P<0.01)。離體器官熒光成像顯示,注射48小時后納米探針在腫瘤及網狀內皮系統器官(肝、腎、肺)中均有較高蓄積(圖4I,J)。這些結果共同證實RVLu@ICG具有精準的結直腸癌靶向能力。

基于Lu3?的X射線激活康普頓散射特性,通過靜脈給藥評估了RVLu@ICG對荷瘤小鼠的腫瘤生長抑制作用。將攜帶CT26腫瘤的小鼠隨機分為四組:PBS對照組、RVLu@ICG組、單純放療(RT)組及RVLu@ICG+RT聯合組。如圖5A、D、E所示,未照射的PBS組和RVLu@ICG組腫瘤持續生長;而X射線照射后,RVLu@ICG+RT組表現出顯著增敏效果,腫瘤體積較單純RT組明顯縮小(圖5A、F、G)。第18天解剖顯示,聯合治療組腫瘤重量最輕(圖5B、C),證實其具有腫瘤清除與生長抑制能力。照射后6天小鼠體重短暫下降,第10天恢復至正常水平(圖5H)。為深入評估療效,治療18天后對腫瘤組織進行病理學分析。Ki67增殖標志物染色顯示,聯合組的陽性細胞數顯著低于其他組(圖5I、J);同時該組caspase-3活性明顯升高(圖5I、K),表明RVLu@ICG通過激活caspase-3及其下游通路協同促進腫瘤細胞凋亡。以上結果和HE染色結果共同驗證了RVLu@ICG能有效增強放療誘導的腫瘤細胞死亡并抑制進展。

圖6. 微腫瘤模型、肌內腫瘤浸潤模型和腹部轉移癌模型中RVLu@ICG的手術導航
注射后48小時觀察到最高腫瘤背景比(TBR),確定為近紅外二區(NIR-II)熒光引導腫瘤切除的最佳時機。為評估納米探針對微小腫瘤的術中檢測能力,本文建立了多發性微小腫瘤模型。術中熒光信號與生物發光成像結果高度吻合(圖8A),證實NIR-II熒光成像能精確界定腫瘤邊界。對應HE染色顯示,在NIR-II引導下切除的7個微腫瘤直徑約0.5-3毫米,腫瘤與正常組織分界清晰(圖8B)。值得注意的是,直徑不足1毫米的T3、T4和T5微腫瘤均被準確識別,凸顯RVLu@ICG對術中殘留微小病灶的檢測優勢。
通過構建肌肉內腫瘤浸潤模型,研究者驗證了RVLu@ICG探針在熒光成像系統中精確定位腫瘤的可行性。將CT26-Luc細胞植入BALB/c小鼠肌肉組織形成300-400 mm3腫瘤后,在無菌條件下麻醉荷瘤小鼠。如圖8C所示,注射RVLu@ICG 48小時后,腫瘤邊緣通過NIR-II成像系統清晰顯現(圖8C I,IV)。白光下切除原發灶(P1)后,NIR-II成像發現術床殘留熒光信號(圖8C II,V),遂追加切除(P2)。808 nm激光復檢確認熒光信號消失(圖8C III,VI)。離體成像顯示P1/P2具有強熒光而肌肉組織無信號(圖8E),HE染色證實熒光區域均為腫瘤組織(圖8F),表明該探針可有效區分腫瘤與正常組織。相比之下,ICG組多數殘留腫瘤無熒光信號(圖8D),凸顯傳統染料的局限性。
術后14天生物發光成像顯示,RVLu@ICG引導手術組無局部復發或遠處轉移,而ICG組80%小鼠及對照組全部出現原位復發。生存分析顯示RVLu@ICG組小鼠生存期顯著優于ICG組與白光手術組(圖8G)。進一步在結直腸癌腹膜轉移模型中評估了RVLu@ICG近紅外二區納米探針的術中成像潛力。生物發光成像首先確認了腫瘤存在并提供了大致定位。在無菌條件下對異氟烷麻醉的小鼠實施手術,通過NIR-II熒光成像依次引導腫瘤切除(圖8H)。NIR-II成像清晰顯示了1-8號腫瘤邊界(圖8H),切除組織的HE染色驗證了腫瘤邊緣的精準界定(圖8I)。術后14天的生物發光監測顯示,所有手術區域均未出現局部復發或轉移跡象。
本文成功開發出具有優異生物相容性和高光穩定性的創新型近紅外二區(NIR-II)可降解熒光納米探針RVLu@ICG,該探針集放療增敏、免疫微環境重塑和手術精準導航三大功能于一體。基于高原子序數元素镥(Lu)顯著的X射線吸收效率,RVLu@ICG不僅能增強結直腸癌腫瘤的放射敏感性,還能通過放射增敏效應重塑腫瘤免疫微環境,從而激活免疫系統放大免疫殺傷效應。在多種荷瘤模型實驗中,該探針可精準引導NIR-II熒光成像實現腫瘤切除,顯著提高實驗對象總體生存率。更值得關注的是,該納米探針無毒性且不會造成器官損傷或急性危害,展現出良好的臨床轉化前景。這種多功能探針為結直腸癌制定了完整的精準治療方案:術前通過新輔助放療聯合免疫微環境重塑實現腫瘤細胞清除和瘤體減容;術中借助NIR-II熒光導航精準切除殘余微病灶。這種整合治療策略對改善患者生存預后具有重大意義,有望成為臨床腫瘤治療的優選方案。
參考文獻
Dang Y, Liu X, Zheng Z, et al. Lutetium‐Based Nanoprobes for Radiosensitization with Immune Microenvironment Remodeling and NIR‐II Fluorescence Imaging‐Guided Surgery in Colorectal Cancer[J]. Advanced Science, 2025: e10136.
?? ?? ??
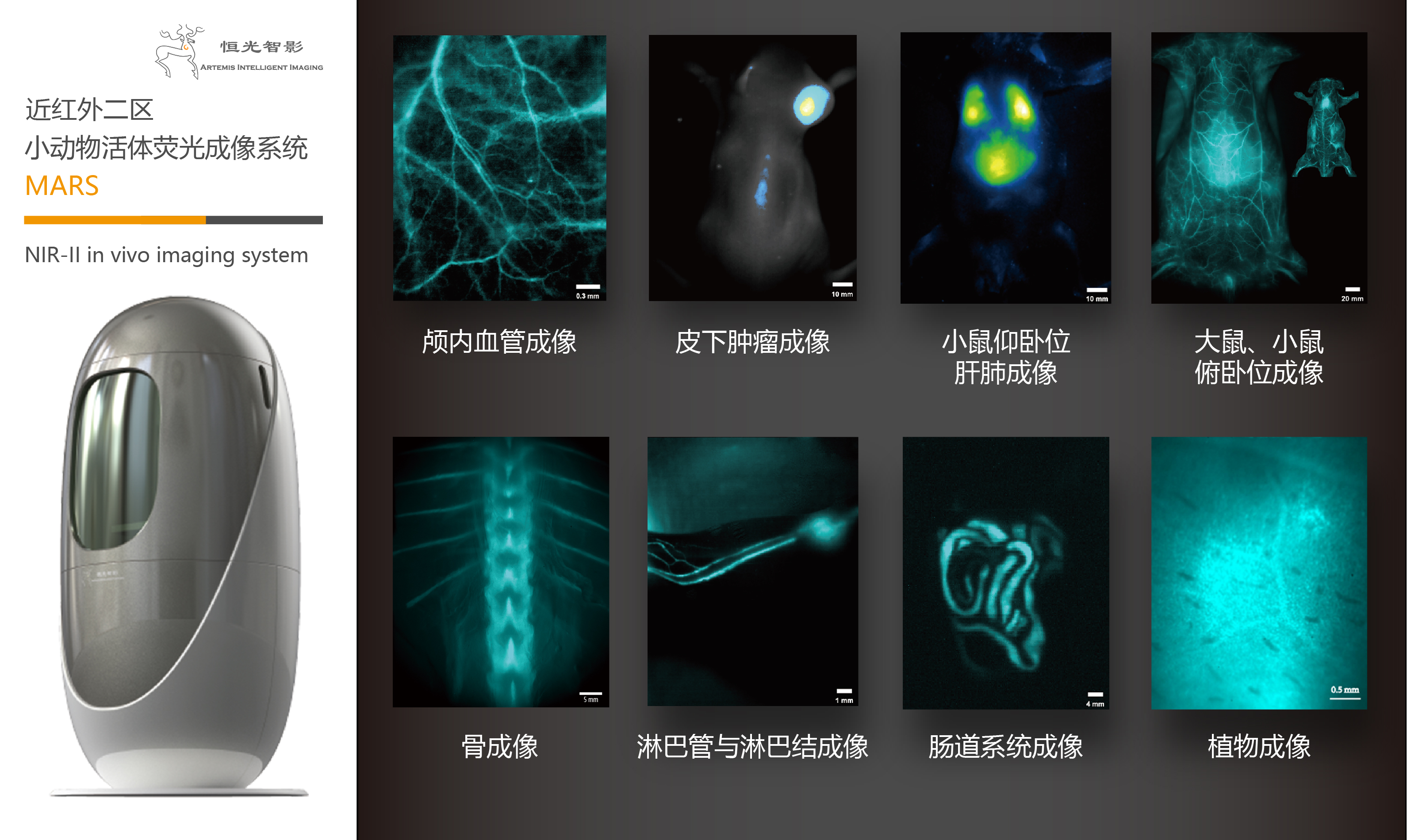
動物活體熒光成像系統 - MARS
In Vivo Imaging System
?? ?? ??
恒光智影
上海恒光智影醫療科技有限公司,被評為“國家高新技術企業"、“上海市專精特新中小企業",獲批主持“科技部重大儀器專項"子課題,榮獲上海市“科技創新行動計劃"科學儀器項目、上海市2025年度關鍵技術研發計劃“計算生物學"項目。
恒光智影,致力于為生物醫學、臨床前和臨床應用等相關領域的研究提供先進的、一體化的成像解決方案。
專注動物活體成像技術,成像范圍覆蓋 400-1700 nm,同時可整合CT, X-ray,超聲,光聲,光熱成像等技術。
可為腫瘤藥理、神經藥理、心血管藥理、大分子藥代動力學等一系列學科的科研人員提供清晰的成像效果,為用戶提供前沿的生物醫藥與科學儀器服務。
請輸入賬號
請輸入密碼
請輸驗證碼
以上信息由企業自行提供,信息內容的真實性、準確性和合法性由相關企業負責,化工儀器網對此不承擔任何保證責任。
溫馨提示:為規避購買風險,建議您在購買產品前務必確認供應商資質及產品質量。