本文要點:在藥物使用中,對多器官功能障礙進行精確且快速的監測至關重要。本文開發了一種多通道近紅外二區(NIR-II)熒光生物成像方法,該方法能夠實時、快速且定量地評估多器官功能障礙。同時,合成了一系列具有不同吸收和發射波長的NIR-II半花菁染料(HDs),通過修飾這些染料,實現了對肝臟、腎臟、胃和腸道的高空間和時間分辨率成像。該方法進一步應用于研究由順鉑(一種已知會導致胃排空問題以及肝腎損傷的藥物)引起的疾病。通過監測這些器官中染料的代謝速率,準確量化了多器官功能障礙,并得到了金標準病理分析的證實。此外,本文還評估了五種馬兜鈴酸(AAs)對多器官功能障礙的影響,發現AA-I和AA-II可引起胃排空障礙,這一發現通過轉錄組學分析得到了進一步驗證。本文的研究引入了一種同時監測多器官功能障礙的新方法,有望加快藥物副作用的評估。

在本研究中,通過擴展共軛體系、替換雜原子以及修飾各種取代模式,創建了一系列發射波長在674至1145納米之間的光譜可調諧的高分子量(HD)庫。研究者還運用合理的分子工程,將HD3熒光團片段與腎臟清除率增強功能片段(單-(6-(1,6-己二胺)-6-脫氧)-β-環糊精)融合,制得HD3-CD,該物質同時具有肝臟和腎臟清除特性。因此研究者能夠進行實時、無創的近紅外二區(NIR-II)成像,以評估順鉑誘導的肝臟和腎臟功能障礙(圖1A)。此外,分別研究了發射波長超過1100納米的耐酸HD6和HD14,以評估順鉑對胃和腸道的損傷(圖1B)。基于此,進一步建立了一個多通道生物成像平臺,利用HD6、HD3-CD和HD14在660、808和915納米激光下的優異光譜區分能力,對肝臟、腎臟、胃和腸道進行監測(圖1C)。這種多色成像技術被用于鑒定由馬兜鈴酸I(AA-I)和馬兜鈴酸II(AA-II)引起的潛在胃排空障礙,并通過轉錄組學分析進一步證實了這一點(圖1D)。

圖1. 用于監測藥物誘導的多器官功能障礙的多路近紅外二區(NIR-II)成像平臺設計
增強共軛是使發射波長紅移的有效方法。基于HD的經典D-π-A結構設計了三種轉換策略。首先,擴展末端部分的共軛體系引入了呋喃苯并[cd]吲哚,它將發射驅動到NIR-II窗口。其次,將雜原子(X)從氧(O)替換為硫(S)、硒(Se)和硅(Si)預計會實現更大的紅移。最后,改變末端雜環中的取代模式(如羥基和乙二胺)可以進行微調,從而為NIR-II多路成像定制合適的熒光團。這一策略導致了14種光譜上不同且兼容的熒光團的開發(圖2A)。所有HDs都可以通過兩條穩健的路線合成:(i)將黃原烯骨架的衍生物與各種吲哚化合物結合,產生HD1-10和HD13-14。(ii)菁ET-1080與3-羥基苯硫酚或物種3縮合形成HD11-12。HD的詳細合成和表征見支持信息。所有染料的純度均大于95%。

圖2. HD的物理和化學性質
在甲醇中研究了HDs的光物理性質,結果總結于圖2A和支持信息圖S1中。HDs的光譜覆蓋了近紅外一區(NIR-I)和二區(NIR-II)窗口,其最大吸收波長(λmaxabs)范圍為659至988 nm,最大發射波長(λmaxem)范圍為674至1145 nm,展現出良好的成像前景(圖2B?G)。與HD1(676 nm)相比,HD2(780 nm)、HD3(850 nm)、HD4(840 nm)和HD5(830 nm)的λmaxem分別紅移了104、174、164和154 nm,表明擴展共軛結構是提升成像性能的有效方法。雜原子(O、S、Se、Si)的替換導致λmaxem從HD3(850 nm)到HD11(855 nm)、HD12(880 nm)和HD13(944 nm)分別紅移了5、30和94 nm,表明硅取代(HD13)比硒、硫和氧更能有效促進光譜紅移。然而,苯環上間位和對位羥基取代對λmaxem的影響較小。此外,基于前期經驗,在HD14結構中同時引入呋喃-苯并[cd]吲哚和乙二胺部分,使其λmaxem紅移至1145 nm,這是HD家族中異常長的發射波長。值得注意的是,HD13(235 nm)和HD14(157 nm)中硅原子取代產生了顯著的斯托克斯位移,可有效減少激發光的干擾。

圖3. 實時體內NIR-II成像
肝臟和腎臟功能障礙是藥物的常見副作用。監測這些功能障礙對于防止腎毒性或肝毒性藥物上市至關重要。綜合考慮成像能力與結構可修飾性后,選擇以HD3為基礎進行改造,通過引入羧基獲得HD3-CAR,最終與腎清除增強組分(單-(6-(1,6-己二胺)-6-脫氧)-β-環糊精,HeβCD)耦聯制備HD3-CD。HD3-CD在水中最大吸收波長(λmaxabs)為704 nm,最大發射波長(λmaxem)為939 nm;在甲醇中λmaxabs為803 nm,λmaxem為940 nm。研究者評估了HD3-CD在肝腎功能障礙監測中的應用效果。以具有顯著腎毒性的化療藥物順鉑(20 mg/kg,72小時)為模型,通過NIR-II窗口動態觀測發現:順鉑處理組小鼠腎臟在HD3-CD注射后1小時和9小時的信號衰減速率(0.07±0.06和0.47±0.04)顯著慢于生理鹽水對照組(0.31±0.09和0.63±0.05)(圖3B);肝臟信號在5小時和9小時的清除速率(0.11±0.2和0.24±0.05)也低于對照組(0.24±0.04和0.39±0.04)(圖3C),這與病理切片(圖S7A-B)及血液生化指標(圖3D-E)結果一致,證實HD3-CD可通過NIR-II成像無創監測順鉑引發的肝腎功能障礙。
順鉑還常引發胃腸道副作用,其強烈的胃腸毒性會降低患者的治療積極性。研究者嘗試建立比鋇餐和內窺鏡等主流技術更安全便捷的近紅外二區(NIR-II)胃腸成像監測模式。HD6、HD7和HD8在酸性條件下能保持穩定的吸收強度。值得注意的是,HD6與HD3-CD的光譜間隔良好,為多重成像提供了基礎。

圖4. NIR-II多重成像
得益于HD6、HD3-CD和HD14的光譜間隔特性,基于近紅外二區(NIR-II)的多器官損傷多重監測成像成為可能。這三種探針的吸收波段間隔近200 nm(圖4A),可分別通過660 nm、808 nm和915 nm激光正交激發且串擾極低——離心管中有機/水溶液的成像實驗顯示:660 nm激發時,有機相與水相的熒光強度比分別為82.0/9.8/8.2和76.4/9.4/14.2(HD6主導);808 nm激發時為1.5/80.5/18和2.2/66.8/31.0(HD3-CD主導);915 nm激發時為9.2/11.9/78.9和1.7/23.6/74.7(HD14主導)(圖4B)。
基于此,對順鉑/PBS處理小鼠進行雙通道成像:靜脈注射HD3-CD(808 nm激發,通道2)后口服HD6(660 nm激發,通道1),實現了胃腸、肝臟與腎臟的長期高對比度監測(圖4C)。給藥0.3小時時,PBS組與順鉑組的腹側觀胃/肝臟信噪比(SNR)分辨率達2.7和10.7,背側觀胃/腎臟分辨率達3.0和21.8(支持信息圖S16A),其代謝特征與既往研究高度一致,證明該技術可創新性評估多器官損傷。
進一步拓展的三通道成像技術中,尾靜脈注射HD3-CD、灌胃HD6后腹腔注射HD14,915 nm通道(通道3)專屬性顯示HD14標記的腸道結構(圖4D)。對照組與順鉑組的肝/腸SNR分辨率分別為11.1和14.0,胃/腸分辨率達4.6和4.2。相比雙通道成像,三通道技術能提供更全面的器官信息并規避病灶導致的成像缺失,但因腸道蠕動和HD14的漸進吸收,其長期監測能力稍遜。綜上,本文建立了可定制的多通道成像技術體系,為探索藥物多器官毒性及加速新藥研發提供了新工具。
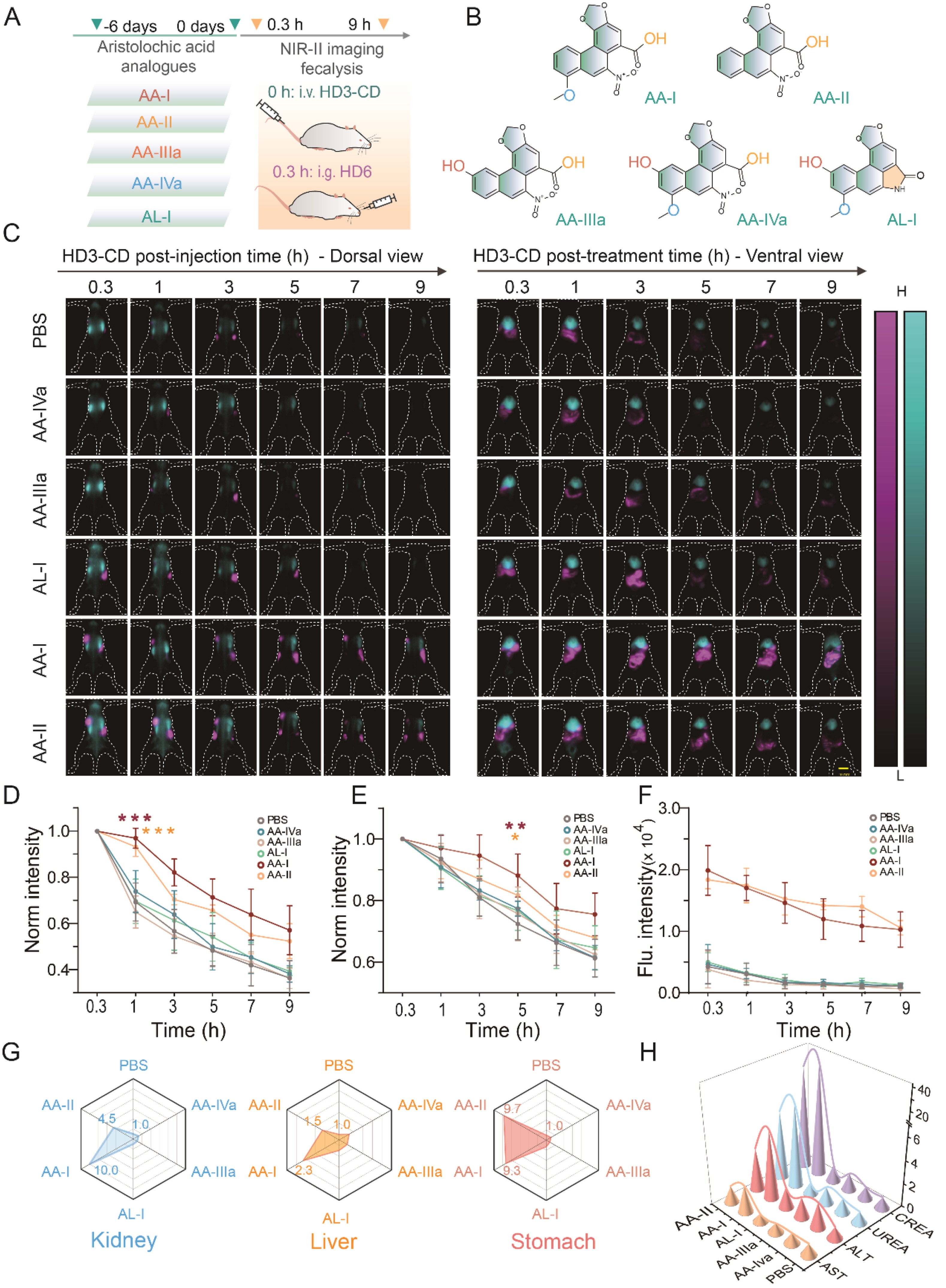
圖5. AAs誘導多器官損傷的實時NIR-II成像和分析
馬兜鈴酸(AAs)是存在于馬兜鈴科植物中的毒性化合物,已知可誘發馬兜鈴酸腎病。通過雙通道成像技術,研究者期望為發現AAs更多潛在毒性提供有效證據。實驗小鼠分別口服代表性AAs(20 mg/kg,包括AA-I、AA-II、AA-IIIa、AA-IVa和AL-I)及PBS對照組,治療6天后尾靜脈注射HD3-CD并灌胃HD6(圖5A-B),利用近紅外成像監測腎臟、肝臟和胃部信號(圖5C)。結果顯示:HD3-CD注射1小時后,各處理組小鼠腎臟信號衰減值分別為AA-I(0.03±0.04)、AA-II(0.07±0.04)、AA-IIIa(0.35±0.07)、AA-IVa(0.26±0.09)、AL-I(0.30±0.10)和PBS組(0.31±0.08),其中AA-I和AA-II組的腎清除效率顯著低于其他組(圖5D);注射5小時后,AA-I和AA-II組的肝臟信號衰減值(0.12±0.07和0.18±0.07)顯著低于對照組(0.28±0.05)及其他處理組(圖5E);胃部熒光信號在AA-I和AA-II組持續偏高,3小時時強度分別達對照組的9.3倍和9.7倍(圖5F)。圖5G綜合對比顯示,AA-I和AA-II組的探針清除效率在肝(5小時)、腎(1小時)、胃(3小時)三個器官均低于AA-IIIa、AL-I和PBS組,表明AA-I和AA-II對肝臟、腎臟及胃功能均有顯著損害。血液生化指標(圖5H)與病理切片進一步驗證該結果與探針清除效率變化趨勢一致。本研究通過雙色成像技術揭示了AA-I和AA-II可能引發的胃排空障礙。

圖6. AA-I/II誘導的肝、腎和胃損傷的蛋白質印跡和轉錄組分析
之后,本文通過Western blot分析了AA-I和AA-II處理組小鼠肝腎組織中炎癥相關蛋白(NF-κB、NLPR3)、纖維化相關蛋白(TGF-β、SMAD3)及凋亡標志物(BAX)的表達水平。腎臟中,與對照組相比,AA-I組的BAX、TGF-β、NLPR3和NF-κB表達均升高,AA-II組的BAX和NF-κB顯著上調(圖6A);肝臟中,兩種處理組的BAX、TGF-β、SMAD3、NLPR3和NF-κB表達均明顯增加(圖6B)。進一步對AA-I和AA-II處理組的胃組織進行轉錄組學分析,主成分分析顯示組間樣本分散而組內聚類良好(圖6C)。差異基因分析發現,AA-I組共有1936個差異基因(上調1268個,下調668個)(圖6D),AA-II組達5973個(上調2757個,下調3216個)(圖6E)。KEGG富集分析表明,AA-I主要影響細胞因子-受體相互作用、病毒蛋白-細胞因子互作、補體凝血級聯、IL-17信號通路、蛋白質消化吸收及趨化因子信號通路(圖6F);而AA-II則顯著干擾核糖體、蛋白質消化吸收、細胞黏附分子、胃酸分泌及血管平滑肌收縮等通路(圖6G),提示兩種毒素通過不同分子機制干擾胃功能動態平衡。
參考文獻
Jiang Pu et al., Rapid discovery of drug-introduced multiple organ dysfunction via NIR-II fluorescent imaging, Acta Phar-maceutica Sinica B
?? ?? ??
動物活體熒光成像系統 - MARS
In Vivo Imaging System

?? ?? ??
恒光智影
上海恒光智影醫療科技有限公司,被評為“國家高新技術企業"、“上海市專精特新中小企業",獲批主持“科技部重大儀器專項"子課題,榮獲上海市“科技創新行動計劃"科學儀器項目、上海市2025年度關鍵技術研發計劃“計算生物學"項目。
恒光智影,致力于為生物醫學、臨床前和臨床應用等相關領域的研究提供先進的、一體化的成像解決方案。
專注動物活體成像技術,成像范圍覆蓋 400-1700 nm,同時可整合CT, X-ray,超聲,光聲,光熱成像等技術。
可為腫瘤藥理、神經藥理、心血管藥理、大分子藥代動力學等一系列學科的科研人員提供清晰的成像效果,為用戶提供前沿的生物醫藥與科學儀器服務。
請輸入賬號
請輸入密碼
請輸驗證碼
以上信息由企業自行提供,信息內容的真實性、準確性和合法性由相關企業負責,化工儀器網對此不承擔任何保證責任。
溫馨提示:為規避購買風險,建議您在購買產品前務必確認供應商資質及產品質量。