聯系電話
- 聯系人:
- 蘇小姐
- 電話:
- 400-820-3556
- 手機:
- 18521301252
- 地址:
- 上海市浦東新區環科路999弄浦東國際人才港13號樓2樓
掃一掃訪問手機商鋪
文章來源公眾號:生物快評 作者:生物快評
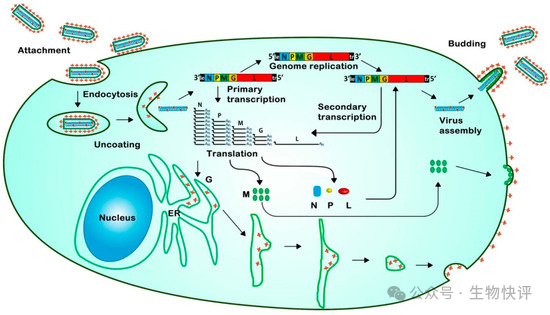
慢病毒原理背景
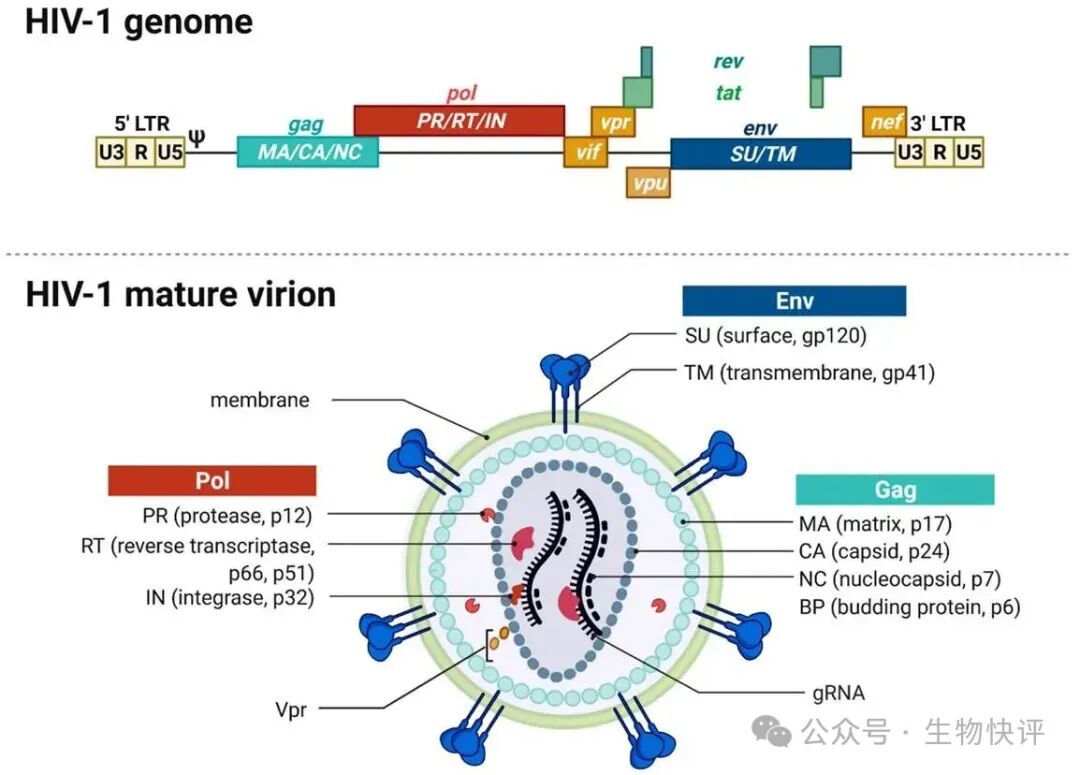
HIV病毒顆粒和基因組
HIV病毒是屬于envelope virus,這個envelope本意指的是信封上蓋的蠟戳,用于封閉信件的作用,這里指的是病毒粒子外面有一層磷脂雙分子脂質層。就是上圖中的綠色部分,這樣的有點是病毒的例子完quan被雙分子層的膜罩住了,那么暴露的抗原自然就少了。相對比non-envelope virus就需要病毒粒子直面宿主的免疫系統。
因為在水溶液中,人體的環境下,膜和膜融合不是天然發生的事情,需要克服膜周邊水分子的排次作用,所以這樣也給病毒和宿主細胞膜融合帶來了另一個問題就是“感染入侵的問題",這里需要進化出一套精密的“分子機器",來完成病毒的膜和宿主細胞膜的融合。這些融合的完成需要依靠“配體-受體"作用來完成。
病毒的蛋白質包括:
Gag: 這個gag是產生結構蛋白,gag這個名稱怎么來的?一般在病毒學研究中,研究者對基因的命名充滿了隨意和簡單直接,不像對人基因的命名要信達雅,這個鬼畜的縮寫是group of antigen,意思是這個病毒蛋白主要激發人體產生抗體的,所以叫做“一組抗原"。
gag蛋白質產生MA/CA/NC。分別是MA: matrix蛋白,矩陣蛋白,結合包膜的作用,類似房屋的頂部支撐,。CA:capsid蛋白,包裹病毒粒子的作用,類似藥物的膠囊殼。NC: nucleocapsid protein,NC是負責包裹病毒的核酸物質。最終通過
“俄羅斯套娃"一樣的結構,得到封裝好的HIV病毒粒子。
pol: pol蛋白是產生病毒的酶相關的蛋白:包括PR: 蛋白酶,RT:逆轉錄酶;IN: 整合酶(負責將DNA整合進入宿主基因組組)。
gp120和gp41,它們是一個復合體的兩個部分,共同被稱為包膜糖蛋白,是HIV病毒入侵人體細胞的“鑰匙",也是艾滋病藥物和疫苗研究最重要的靶點之一。gp120:是暴露在外的“鉤子"或“探頭",負責識別和初步結合目標細胞。gp41:是隱藏的“彈簧dao"或“錨",負責膜融合,即刺穿細胞膜,讓病毒核心進入細胞。
Rev:Rev is a transactivating protein that is essential to the regulation ofHIV-1 (and other lentiviral) protein expression。負責完整RNA從細胞核運輸到細胞質中,完成病毒完整RNA和蛋白質的組裝。
Tat: Trans-activator oftranscription(反式轉錄激活因子),大幅增強病毒基因的轉錄(將DNA模板轉化為RNA的過程),沒有Tat,HIV的復制效率會極低。
HIV的gp120/gp40包膜為VSV病毒的G蛋白
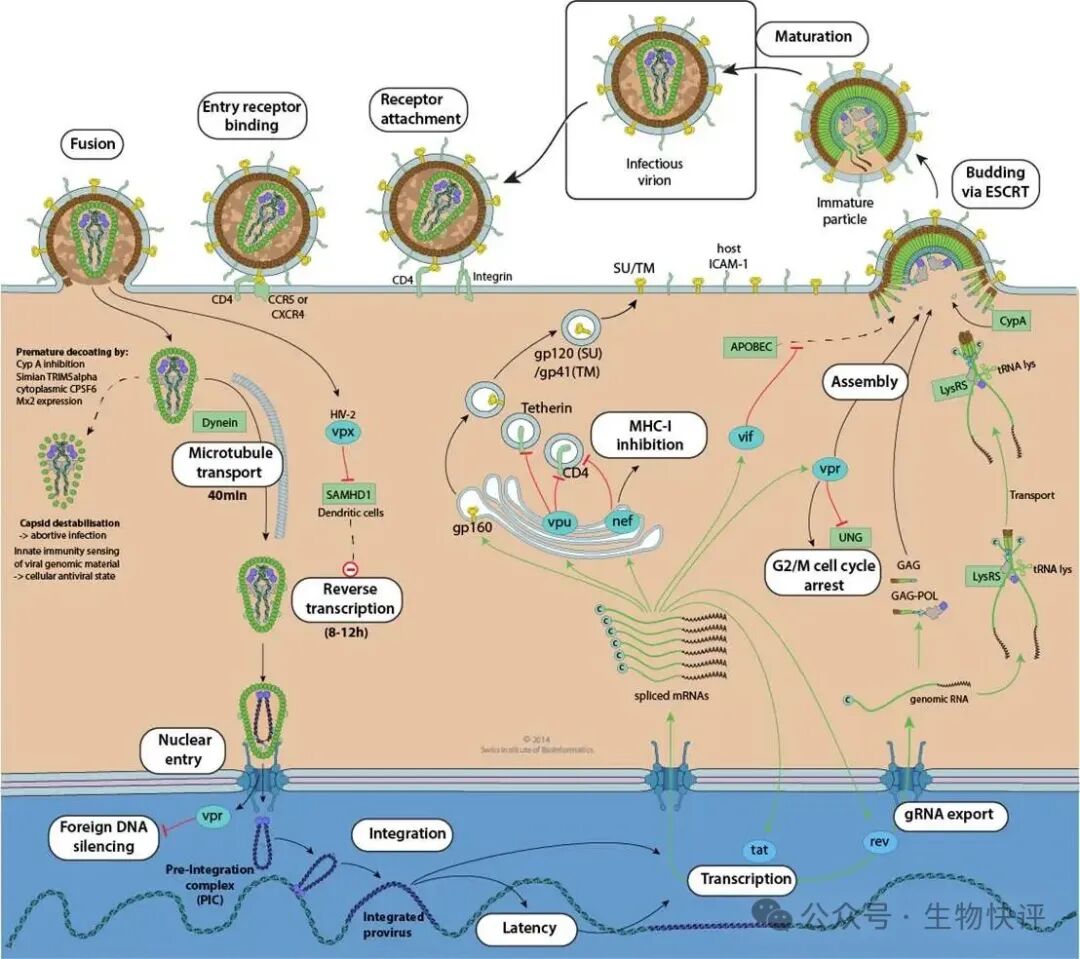
HIV病毒通過受體gp120結合受體CCR5、CD4之后,然后激動觸發gp40暴露,gp40結構發生變化將gp40的疏水端插入到細胞膜上,介導病毒和細胞膜的融合。然后HIV capsid釋放到了細胞質中,然后capsid經過激動蛋白結合并且在微管蛋白上運動,這樣capsid運輸到了核孔,最后向核孔內釋放出病毒粒子中的酶和核酸。隨后就發生了逆轉錄、整合等作用。
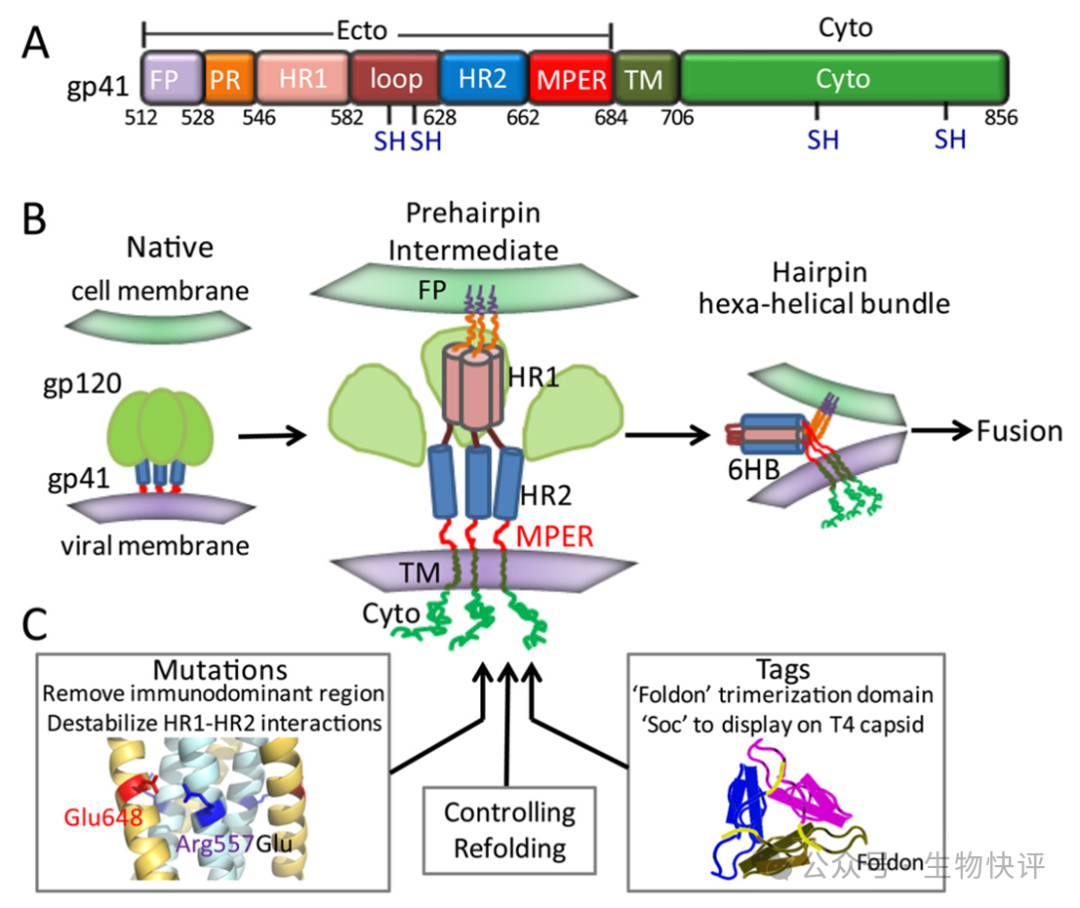
DOI 10.1074/jbc.M112.424432
HIV的gp160在病毒包裝過程中經過宿主的蛋白酶水解得到gp120/gp41,兩者是通過二硫鍵形成二聚體,然后在形成三聚體。Gp120糖基化程度高,且突變多,相當于亞穩態的gp41埋藏在gp120中,當gp120結合CD4\CCR5等分子后,gp41改變而結合細胞膜,最后膜融合,病毒進入細胞。
Viruses 2024, 16(12), 1933;
再看VSV病毒通過G蛋白結合LDL-R,因為LDL-R天然的作用是結合脂蛋白,結合之后LDL-R和脂蛋白一起通過鈣網蛋白被內吞,這樣細胞就完成了脂質的攝入;VSV病毒的G蛋白就利用這個“運輸的后門",VSV的G蛋白結合LDL-R之后,細胞內吞進入endosome,VSV病毒進入到endosome中激發endosome中的質子泵而endosome提高了H+濃度,即pH下降。Endosome進一步轉為lysosome,因為pH的下降,VSVG蛋白中一些組氨酸在pH中電荷改變導致VSVG結構變化,然后VSVG的疏水端暴露出來結合到lysosome的膜上,類似VSVG在lysosome中“撕開"膜,VSV病毒粒子釋放到了細胞質中,隨后VSV釋放遺傳物質,隨后整個遺傳物質復制、RNA的復制、轉錄,病毒組裝均在細胞質中。
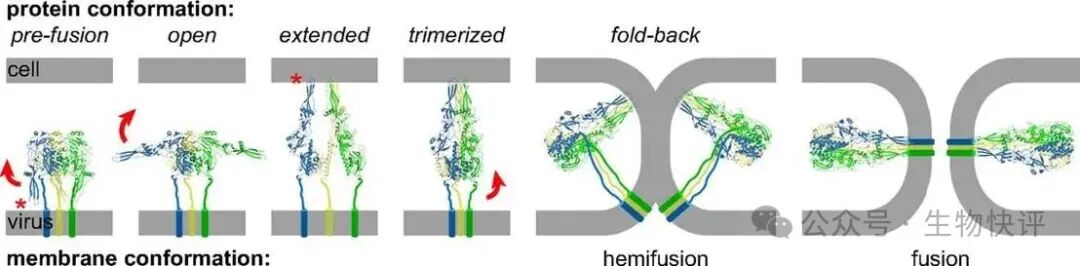
目前慢病毒都將gp120/gp41復合物換成了VSV的病毒的包膜,那么這種改變其實除了改變HIV的靶向性,也改變了病毒的生命周期中的路徑。
我們利用VSV.G包裝的慢病毒通過逃逸endosome之后,慢病毒capsid依然比較完整,還可以接著依靠Dynein完成運輸到細胞核。設想一下,如果VSV.G的融合逃逸能力和融合速度不足夠,響應pH下降的速度較慢,那么慢病毒的capsid則會在lysosome中無法快速逃逸,最終LV殼就會破壞而進入不了細胞核。
第二代慢病毒和第三代慢病毒的區別
2nd vs 3rd Generation Lentiviral Systems
2nd vs 3rd Generation Lentiviral Systems | ||
Feature | 2nd Generation | 3rd Generation |
Transfer Plasmid | Can be packaged ONLY by a second generation packaging system that includes TAT | Can be packaged by both 2nd and 3rd generation packaging systems |
Packaging Plasmid | All on one plasmid: Gag, Pol, Rev, Tat | Two plasmids: one encoding Gag and Pol and another encoding Rev |
Envelope Plasmid | Interchangeable: usually encodes for VSV-G | Interchangeable: usually encodes for VSV-G |
Safety | Safe. Replication incompetent: Uses 3 separate plasmids encoding various HIV genes. | Safer. Replication incompetent and always SIN: Uses 4 plasmids instead of 3 and eliminates the requirement for Tat. |
LTR viral promoter | Wild type | Hybrid: 5'LTR is partially deleted and fused to a heterologous enhancer/promoter such as CMV or RSV |
通過上面的對比,我們可以發現,核心區別2nd慢病毒需要TAT,而3nd慢病毒不需要TAT;2nd中的gag、pol、rev、tat在一個質粒,而3nd慢病毒體系中,gag\pol為同在一個質粒,而rev在一個質粒中。
那么這個Tat發揮了什么作用了呢?為什么3nd慢病毒就可以不依靠它了呢?
我們先來看看HIV 基因組是如何復制的?
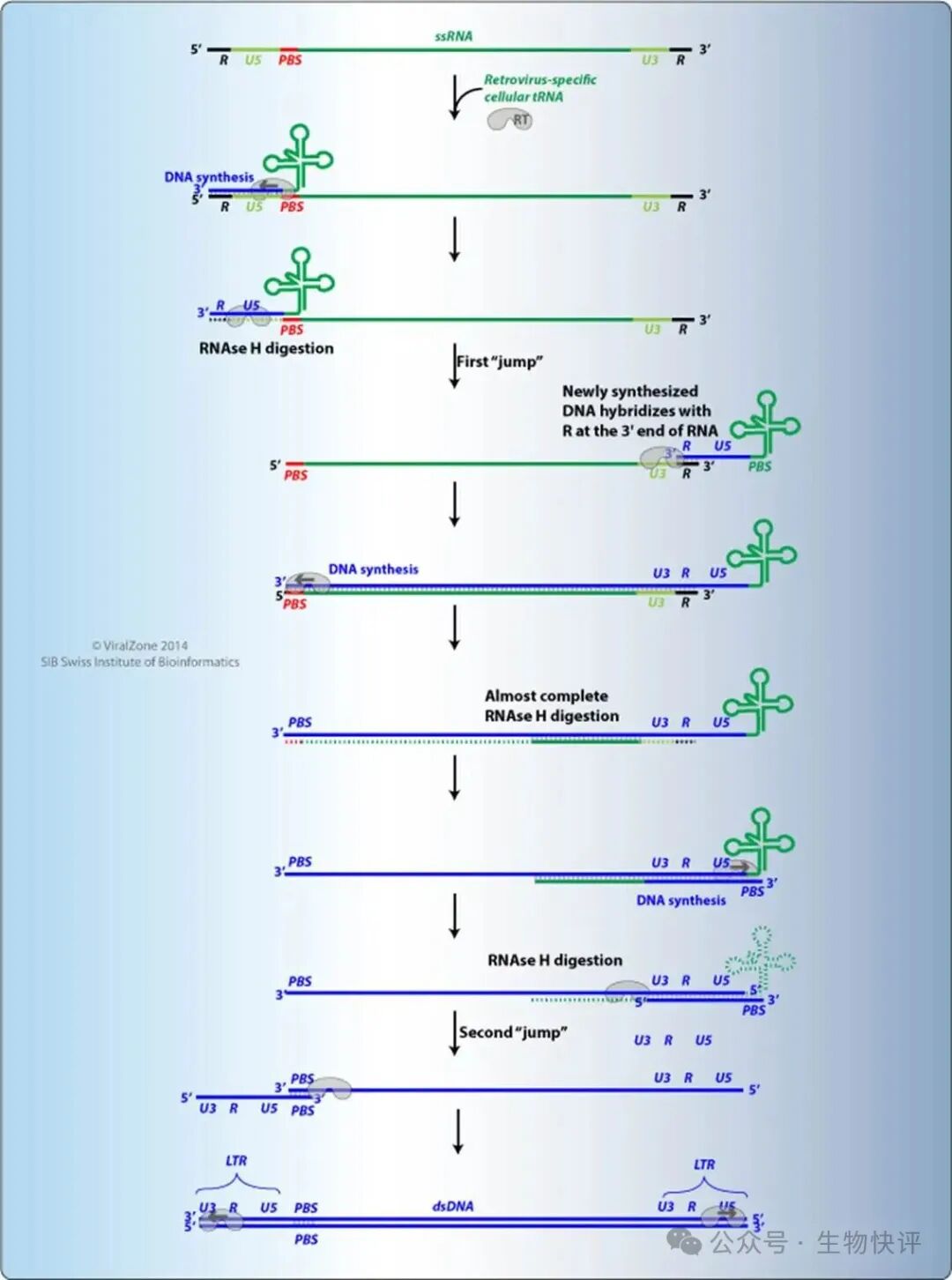
這個圖顯示是HIV ssRNA,逆轉錄得到dsDNA的過程:
守選DNA->RNA轉錄,需要一個“引子",比如真核生物轉錄所需要的引物酶(primase),病毒利用的是宿主的tRNA,tRNA結合到PBS上,tRNA充當了引物,從tRNA的5’-3’合成一段DNA,這段DNA和HIV的LTR的R-U5配對。
然后這個R-U5-tRNA的分子“跳躍"到HIV ssRNA的3’端繼續依靠R配對,生成DNA,這里注意寫到的RNA引物額外攜帶了新生的U5。新生的DNA和RNA形成DNA:RNA雜交鏈,隨后RNA基本上被RNaseH降解,而在多聚嘧啶PPT剩余部分RNA充當引物,繼續合成DNA,此時DNA攜帶了U3-R-U5,成為了完整的3‘LTR。隨后這個DNA發生"跳躍"到HIV DNA的5‘端,通過形成PBS雜交DNA:DNA,繼續得到dsDNA,此時dsDNA的兩端都是完整的LTR。
然后我們要知道dsDNA如果整合到宿主基因組后,HIV的U5類似啟動子來轉錄HIV DNA生成RNA。有兩個問題:1)5‘LTR的U3啟動HIV DNA 轉錄,但是3’ LTR的U3也會啟動下游基因的轉錄,如果下游是抑癌基因則有風險。2)U3啟動HIV DNA轉錄效率低下。
宿主依靠TAT提高轉錄水平:當病毒的DNA整合到宿主細胞的染色體后,細胞的轉錄機器(RNA聚合酶II)會開始讀取病毒基因,合成病毒RNA。遇到“卡頓":但在沒有Tat的情況下,這個轉錄過程在病毒基因的起始階段非常緩慢、低效,經常中途停止,只能產生非常短小的RNA片段。這就像一輛車剛啟動就熄火,無法跑完荃程。Tat蛋白會特異性結合到這些剛合成出來的、短小的病毒RNA的一個特殊區域,稱為 TAR。Tat-TAR的結合就像一個“救援信號",它會招募一大群宿主細胞的輔助因子(如P-TEFb)。這個復合體(Tat + TAR + 宿主因子)能極大地提升RNA聚合酶的“工作效率"。
舉例子:

HIV野生型的基因組ssRNA結構
這里需要特別注意R-U5,5端獨特序列(Unique to the 5’ end);U3-R中的3‘ 端獨特序列(Unique to the 3’ end)。
當HIV基因組整合到宿主基因組后,前病毒就變成了宿主細胞的一部分(即DNA序列)。這時,dsDNA序列的5端是U3-R-U5-genome-U3-R-U5(見上HIV 基因組逆轉錄的示意圖).
HIV整合后轉錄時,U3區域發揮轉錄激活啟動子的作用:U3區域內包含了許多關鍵的調控序列,可以結合宿主細胞的轉錄因子(如NF-κB, SP1等),并且這個轉錄活性依然不足夠,病毒自身的Tat蛋白(通過TAR元件,位于R區)。當這些因子結合到U3區域后,它們會招募細胞的RNA聚合酶II,啟動病毒基因的轉錄。
第二代慢病毒的質粒圖譜
Addgene的pWPT-GFP (Plasmid #12255)

這個是二代2nd病毒目的載體。5’LTR是完整的LTR(即U3-R-U5),truncated 3’LTR(R-U5)缺少U3。如果這個載體進行慢病毒包裝,那么就相當于HIV在宿主基因中轉錄出來ssRNA包裝進入慢病毒中,ssRNA的結構是:R-U5-GOI(Gene of Interest)-R。在這個過程中,需要完quan依靠包裝載體自帶的5’LTR的U3啟動轉錄,所需需要加入TAT協助轉錄得到更多的ssRNA,提高病毒產量。
當這個ssRNA經過逆轉錄后得到dsRNA,其結構是:R-U5-GOI-R-U5。這樣目的基因就依靠自身的啟動子轉錄(比如這里的EF1A),而3’LTR并沒有U3,所以也不會對下游基因產生激活轉錄。
第三代慢病毒的質粒圖譜
Addgene的pLVpuro-CMV-N-EGFP(Plasmid #122848)
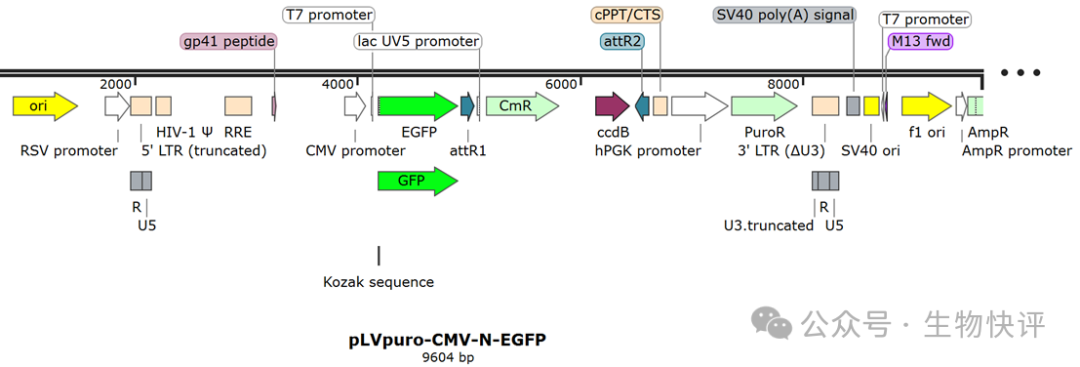
這個是二代3nd病毒目的載體。5’LTR是truncated LTR(即R-U5),3’LTR(U3.truncated-R-U5),根據生物過程,這個質粒轉染進入細胞,因為5LTR缺少U3,他是無法轉錄出ssRNA的,那么怎么辦呢?這里額外加入外源強啟動子RSV-promoter等轉錄出的ssRNA。這個ssRNA的結構是R3-U5-GOI-U3.truncated-R,因為這個U3.truncated很短已經缺少激活能力,所有也不會激活下游基因。因為慢病毒的5’LTR已經缺少U3且用了外源強啟動子, 那么自然也就不需要TAT了。
第二代、第三代慢病毒都需要的rev是什么
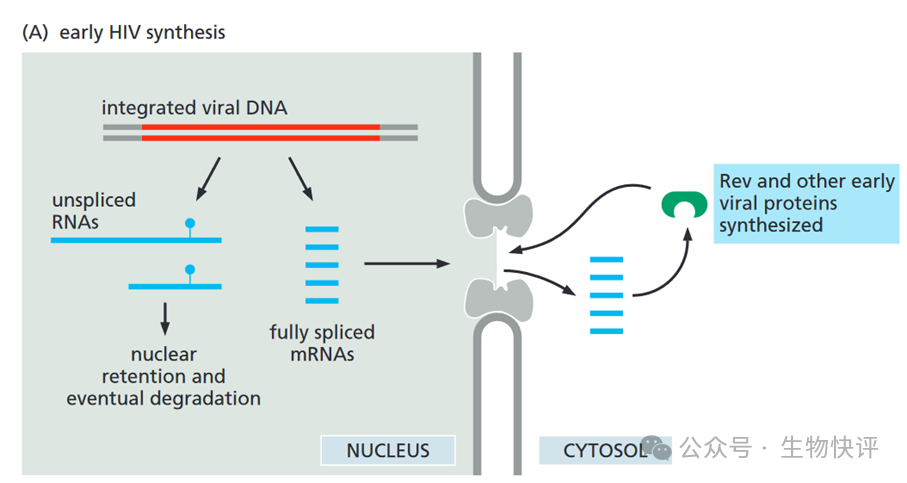
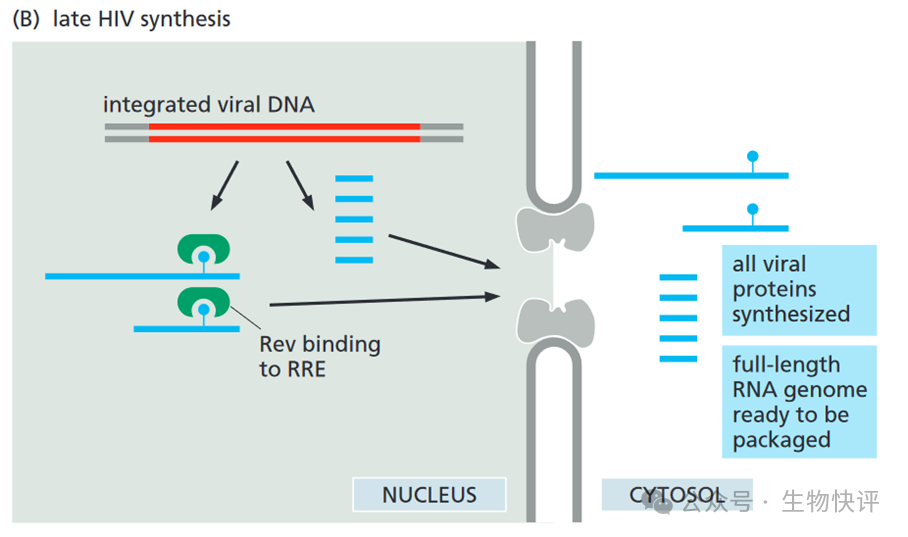
Rev是ssRNA轉錄后運輸出細胞核的關鍵。
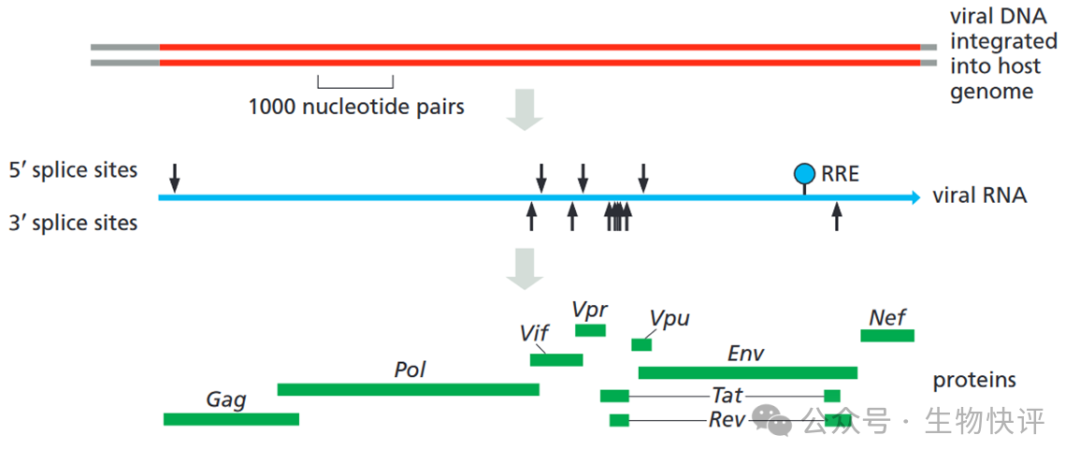
Once inserted, the viral DNA can be transcribed as one long RNA molecule by the host cell’s RNA polymerase II. This transcript is then spliced in many different ways to produce more than 30 different species of mRNA, which in turn are translated into a variety of different proteins. In order to make progeny virus, entire unspliced viral transcripts must be exported from the nucleus to the cytosol, where they are packaged into viral capsids and serve as the viral genome.
The block is overcome by a viral-coded protein (called Rev) that binds to a specific RNA sequence (called the Rev response element; RRE) located within a viral intron. The Rev protein interacts with a nuclear export receptor (Crm1), which directs the movement of viral RNAs through nuclear pores into the cytosol despite the presence of intron sequences.
慢病毒制備In vivo CAR-T
核心原理
慢病毒的VSV-G結合LDL-R通過內吞進入細胞,這個過程分解動作是:VSV-G結合LDL-R,然后病毒粒子在endosome里面通過VSV-G結構變化然促進病毒膜和endosome膜融合。慢病毒in vivo感染的原理核心是:對VSV-G的結合LDL-R的能力破壞,保留VSV-G融合能力。
靶向分子CD3、CD5、CD7等scFV、CD3 VHH可以獨立表達在細胞上,病毒粒子出膜的時候自然攜帶了這些分子。
In vivo慢病毒靶向T細胞是否需要激活T細胞
雖然慢病毒可以感染非復制的細胞,但是因為T細胞靜息時染色質開放程度低,自然是需要T細胞激活更好,但是是否需要強烈激活,應該是不需要。溫和的激活是有效的,過度的激活是無益處的。
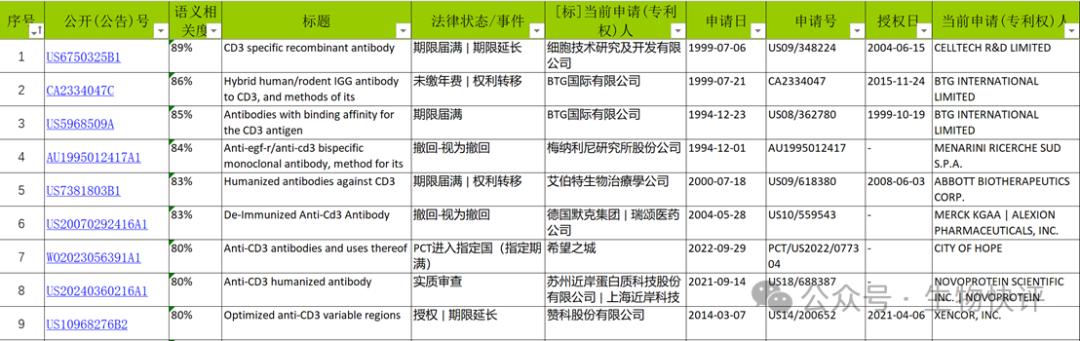
靶向T細胞的CD3抗體有多少
根據zhuan利檢索,潛在越有300多個靶向CD3的各種形式的抗體(按照同族zhuan利計算)。
需要考慮的是:
1)靶向CD3的分子最好是能夠激發CD3符合的內吞,盡量快速完成病毒粒子的內吞。
2)靶向CD3的抗體最好是能夠溫和或者較強激活T細胞,促進感染效率。
3)靶向CD3的抗體親和力不需要很高,適中即可。因為病毒的出膜、感染等,高親和力的靶向會感染病毒的感染路徑,比如影響了病毒的endosome逃逸。

 中級會員·6年
中級會員·6年
